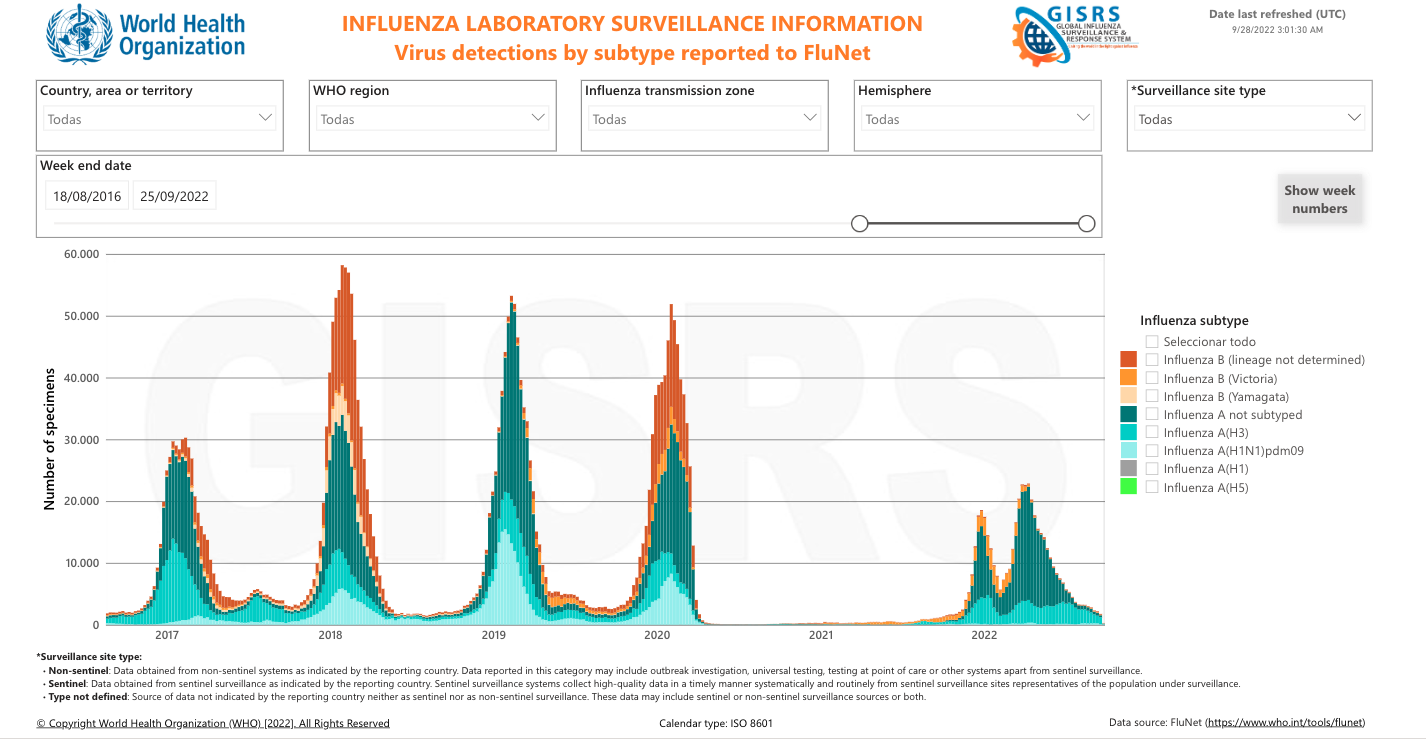
La diversidad y composición de la microbiota intestinal podría influir en la gravedad de la COVID-19
Si buscas en la base de datos PubMed los artículos sobre microbiota y COVID-19 aparecen más de 950 artículos científicos desde 2020 (el 40% de ellos son revisiones). La razón es que prácticamente todo hoy en día se relaciona con la microbiota, y la COVID-19 no podía ser menos.
Sabemos que la puerta de entrada del virus SARSCoV2 al interior de las células es el receptor ACE2. Esta proteína también está presente en la superficie de las células epiteliales intestinales, por lo que el intestino también es un órgano diana del virus. De hecho, uno de los síntomas de la infección por SARSCoV2 es la diarrea, el virus se excreta por las heces y puede transmitirse por la ruta de fecal-oral (por eso, uno de los sistemas de vigilancia durante la pandemia ha consistido en monitorizar la presencia del ARN del virus en aguas residuales). Se ha comprobado además que los pacientes con COVID-19, especialmente los que padecen una COVID-19 persistente o duradera, presentan síntomas gastrointestinales, diarrea, dolor abdominal, pérdida de apetito, náuseas y vómitos, y en general una menor diversidad microbiana (disbiosis intestinal).
La composición de la microbiota intestinal puede regular la acción de los patógenos y viceversa, la presencia de microorganismos patógenos influye directamente en la microbiota. Así, los pacientes con una alteración de la microbiota intestinal, presentan un aumento de patógenos oportunistas y una disminución de bacterias beneficiosas. Se ha comprobado que la COVID-19 presenta una mortalidad alta en personas mayores, inmunocomprometidos o con otros problemas de salud o patologías, como la diabetes. Se sabe que las personas con diabetes, por ejemplo, presentan también una menor diversidad microbiana intestinal. Por estas razones, es muy interesante conocer cómo puede influir la diversidad y composición de la microbiota intestinal en la gravedad de la COVID-19.
Se desconoce el mecanismo molecular concreto de cómo se podría relacionar la microbiota intestinal con la gravedad de la infección por SARSCoV2
Aunque no se conoce el mecanismo molecular concreto de cómo se podría relacionarse la microbiota intestinal con la gravedad de la infección por SARSCoV2, existen algunas hipótesis interesantes. El genoma del virus se detecta en heces en más del 85% de los pacientes infectados, incluso más de 30 días después del comienzo de la infección. Se ha demostrado además que existe multiplicación viral en la mucosa del intestino delgado. Aunque no se ha encontrado daño tisular, el virus puede causar un daño indirecto.
La unión del virus al receptor ACE2 intestinal puede generar una respuesta de aumento de la inflamación por estimulación de citoquinas proinflamatorias y desregulación del sistema inmunitario. Esto podría alterar la viabilidad de los enterocitos (las células del epitelio intestinal), generar una disfunción en la barrera intestinal e influir en la ecología de la microbiota. Todo esto puede generar dolor, aumento de la permeabilidad intestinal y diarrea.
En pacientes con COVID-19 se ha observado, por ejemplo, una disminución de la diversidad bacteriana intestinal: disminuyen algunos grupos y géneros beneficiosos como Bacteroides, Roseburia, Faecalibacterium prausnitzii, Eubacterium rectale, Bifidobacterium, Ruminococcus, Lachnospiricaea, mientras que aumentan otros como Streptococcus, Rothia, Veillonella, Clostridium hathawavy, Actinomyces viscosus, Bacteroides nordii y otros patógenos oportunistas que se sabe que causan infecciones bacterianas en el hospedador. Estos cambios pueden persistir incluso más de 30 días después de haber eliminado totalmente el virus. Estos resultados no significan que los cambios en la microbiota sean la causa de una COVID-19 más grave, pero sí pueden contribuir a un mejor o peor pronóstico, o a explicar una diferente susceptibilidad individual según la persona. Por ejemplo, una condición preexistente de disbiosis intestinal podría explicar por qué respondemos de forma distinta a la enfermedad.
¿Podría la dieta alterar la microbiota intestinal y tener un cierto papel preventivo con la COVID-19?
Se sabe que las personas obesas con problemas de nutrición, son mucho más susceptibles a la gravedad por SARSCoV2. Para comprobar la hipótesis de que algunos microorganismos concretos pudieran tener alguna influencia en la progresión de la infección por SARSCoV2, algunos autores han analizado la correlación entre microorganismos y severidad de la enfermedad. Se ha encontrado, por ejemplo, una correlación negativa entre la severidad de la enfermedad y la abundancia de algunas bacterias como Faecalibacterium prausnitzzi y Alistipes onderdonkii, asociadas al metabolismo del triptófano y al mantenimiento de homeostasis inmune.
Faecalibacterium prausnitzzi se considera un biomarcador de buena salud, y su presencia se reduce en dietas occidentales (ricas en grasas animales, azúcar y alimentos procesados) y se aumenta en dietas mediterráneas (ricas en verduras y frutas, pescado, frutos secos, cereales no refinados…). Además, la dieta mediterránea se ha relacionado con un cierto efecto anti-inflamatorio, mientras que la dieta occidental tendría el efecto contrario, pro-inflamatorio. Algunos estudios preliminares han sugerido que la adherencia a dietas mediterráneas se ha asociado a una menor tasa de mortalidad por COVID-19. Quizá algunos alimentos (ricos en vitaminas A, C, D, E, omega-3, zinc, hierro, y fibra que favorece la producción de ácidos grasos de cadena corta, ver más adelante) pudieran tener un cierto efecto en disminuir la gravedad de la enfermedad, por tener un impacto positivo en el estado nutricional y la respuesta inmunitaria.
Por otra parte, bacterias como Coprobacillus, Clostridium ramosum, Clostridium hathaway y Erysipelotrichaceae, que se han relacionado con diarreas y la gravedad de la enfermedad inflamatoria intestinal, también muestra una correlación positiva con la gravedad de la COVID-19. Coprobacillus, por ejemplo, afectan a la expresión del receptor ACE2 en células del colon en ratones y según algunos autores la sobreexpresión de ACE2 promueve la infección por SASRCoV2. Quizá la expresión del receptor podría estar modulada por la microbiota intestinal e influir en su estructura y función, lo que podría explicar diferencias de susceptibilidad individual.
El efecto de la disbiosis intestinal también está relacionado con cambios en el metabolismo bacteriano. Los cambios en la microbiota intestinal relacionados con la COVID-19 suponen una disminución de bacterias productoras de ácidos grasos de cadena corta (SCFA, Short Chain Fatty Acid) y un aumento de patógenos oportunistas. Esos cambios en SCFA se han relacionado con un aumento de la susceptibilidad a infecciones secundarias, lo que aumenta la mortalidad de otras infecciones como las respiratorias.
Probióticos y COVID-19
Si la hipótesis de que la composición y diversidad de la microbiota intestinal pueden estar implicadas en la gravedad de la COVID-19 es cierta, se podrían plantear estrategias para modular la microbiota en pacientes con la enfermedad. Aunque no se ha explorado lo suficiente el uso de probióticos en paciente con COVID-19, algunos trabajos sugieren que el posible efecto beneficioso de ciertos probióticos podría estar relacionado con la producción de SCFA y el estímulo del sistema inmunitario asociado con el intestino (GALT, Gut Associated Lymphoid Tissue). En un estudio con 99 pacientes hospitalizados con COVID-19 y 101 individuos sanos control a los que se les administró un probiótico (una mezcla Lactobacillus rhamnosus, Bifidobacterium bífidus, B. longum y B. infantis), no se observó ninguna diferencia: no mejoró la tasa de mortalidad, duración enfermedad, admisión a UCI, necesidad de oxígeno, daños hepáticos, ni hubo cambios en marcadores de inflamación. Sin embargo, el tratamiento con el prebiótico fue efectivo para tratar la diarrea asociada a la COVID-19 (que fue más leve), o para prevenir infecciones hospitalarias secundarios debidas al tratamiento con antibióticos. En este momento, hay más de 20 ensayos clínicos en curso para valorar el uso de probióticos en pacientes con COVID-19.
De momento, todo esto son datos indirectos. Seguimos sin saber el mecanismo que hay detrás de todos estos fenómenos y son necesarios más estudios, pero parece que existe una asociación directa entre disbiosis y gravedad de la enfermedad. Quizá la disbiosis podría ser un buen marcador del pronóstico de la gravedad de la infección por SARSCoV2.
Esta entrada está basada en esta referencia:
Gut Microbiota and COVID-19: Potential Implications for Disease Severity. Rocchi, G, y col. Pathogens 2022, 11(9), 1050.