Investigadores del CIMA y CUN de la Universidad de Navarra desarrollan un nuevo prototipo de vacuna contra la COVID-19.
Una de las proteínas más importantes del coronavirus SARSCoV2 es la proteína S, la espícula (spike) de la envoltura, que se proyecta hacia el exterior del virus. Esta proteína tiene dos subunidades, S1 y S2. En la subunidad S1 se localiza la zona que se une al receptor ACE2 de la célula, que se denomina dominio de unión al receptor (Receptor Binding Domain, RBD). Es la llave del virus que encaja en la cerradura de la célula, que hace que el virus entre al interior de la célula. Además, los anticuerpos que se producen frente a esa zona RBD de la proteína S son capaces de neutralizar o bloquear al virus impidiendo su entrada. Por eso, varias de las vacunas contra el SARCoV2 emplean la proteína S.
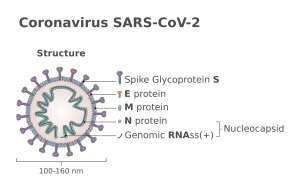
Una estrategia para desarrollar vacunas consiste en diseñar pequeños trozos de esa zona RBD de la proteína S, péptidos de unos pocos aminoácidos que se puedan emplear como antígenos que estimulen la producción de anticuerpos que bloqueen al virus. Son las que se denominan vacunas de subunidades. Estos péptidos se suelen administrar junto con alguna sustancia que estimulan de forma inespecífica el sistema inmune y aumentan o generan una respuesta más potente: los adyuvantes.
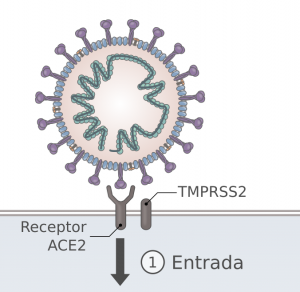
Investigadores navarros han identificación una parte de esa zona RBD de la proteína S del virus SARSCoV2 que es fundamental para el desarrollo de vacunas de subunidades, publicado en Emerging Microbes & Infections.
Para ello, han diseñado y sintetizado una colección de péptidos de 15-35 aminoácidos que se solapan entre sí y cubren la región comprendida entre el aminoácido 401 y el 515 de la proteína S. Han inmunizado ratones con esos péptidos y han comprobado que los que corresponden a la región 446-480 son los más inmunogénicos, es decir, los que estimulan una mayor producción de anticuerpos. En concreto los péptidos de 35 aminoácidos probablemente por adoptar una conformación, una estructura más parecida a la proteína original. Además, estos ensayos preliminares demostraron que esos anticuerpos eran capaces de neutralizar al virus SARSCoV2 in vitro: reducían la infectividad del virus en cultivos de células Vero-E6 entre un 80-95%.
A continuación, probaron la capacidad de estimular anticuerpos de estos péptidos juntos con varios tipos de adyuvantes y comprobaron que el que inducía una respuesta inmune más potente era el CpG ODN/alum (Cytosine phosphoGuanosine OligoDeoxyNucleotide; una mezcla de una secuencia no específica de ADN bacteriano que contienen los dinucleótidos citosina y adenina en forma no metilada junto con aluminio en forma de sulfato).
Los péptidos seleccionados también inducían una respuesta inmune celular de tipo CD4 y CD8 en distintos tipos de ratones.
A largo de la pandemia se han detectado la aparición de mutantes del virus que acumulan cambios en algunas zonas de la proteína S. Algunas de estas variantes se han denominado de preocupación por su mayor transmisibilidad y su potencial capacidad de ser más infectivas o de evitar la detección inmunitaria. Actualmente se reconocen tres variantes de preocupación denominadas beta, gamma y delta.

En el desarrollo de vacunas, interesa que éstas protejan también frente a las nuevas variantes del virus. Por ello, los autores comprobaron si los anticuerpos que inducían los péptidos seleccionados eran capaces de reconocen también la proteína S con las mutaciones presentes en estas variantes de preocupación. Y en efecto, los péptidos generaban una respuesta inmune capaz de neutralizar proteínas S con las mutaciones L452R, E484K, N501Y presentes en esas variantes.
Una vez demostrado que estos péptidos provocan una potente respuesta inmune y celular contra la zona RBD de la proteína S en los ratones, quedaba la prueba de concepto: ¿son capaces también de proteger frente a una infección por SARSCoV2?
Para ello, además de probar con el péptido de la región 446-480, ensayaron también con el péptido en su forma cíclico, que denominaron 446-488cc. Esta forma cíclica contenía un puente disulfuro entre las dos cisteínas del péptido y tiene una conformación más parecida a la de la proteína original. Como controles de este experimento emplearon la proteína RBD junto con el adyuvante o el adyuvante solo sin antígeno alguno. Los ratones recibieron dos inmunizaciones y diez días después de la segunda, fueron infectados con una dosis letal del virus SARSCoV2 (100.000 partículas víricas por ratón) por vía intranasal. Para este ensayo emplearon ratones transgénicos que expresan en sus células el receptor ACE2 humano (ratones K18-hACE2), ya que los ratones normales son inmunes al SARSCoV2.
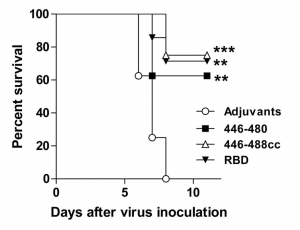
El péptido 446-480 y el péptido cíclico 446-488cc protege a los ratones transgénicos K18-hACE2 de una dosis letal de SARSCoV2. Se muestra el % de supervivencia de los ratones después de la inoculación con el virus. Como controles se emplearon el adyuvante sin antígeno y la proteína completa RBD.
Todos los ratones del grupo control que solo había recibido el adyuvante murieron a los 8 días. Sin embargo, el 62,5% de los ratones vacunados con el péptido 446-480, el 75% de los inmunizados con el péptido cíclico 446-488cc y el 71% de los inmunizados con la proteína completa RBD se recuperaron y sobrevivieron.
La conclusión de este magnífico trabajo es que un péptido de la región RBD de la proteína S induce una potente respuesta de anticuerpos y celular capaz de proteger frente a una dosis letal del virus SARCoV2, … en ratones. Este trabajo es una evaluación preclínica, pero sienta las bases para desarrollar posibles vacunas peptídicas frente al SARSCoV2.
Varias son las ventajas de esta tecnología: son vacunas muy fáciles de diseñar, sintetizar y fabricar; su producción mediante síntesis química es muy homogénea; su diseño es muy flexible y se puede adaptar rápidamente a nuevas variantes del virus que puedan surgir; además, el producto (los péptidos) son muy estables y no necesitan bajas temperaturas para su almacenamiento y distribución.
Se trata de un ejemplo de ciencia básica esencial para desarrollar nuevas estrategias contra el SARSCoV2 o contra futuras amenazas.
Referencia: Preclinical evaluation of a synthetic peptide vaccine against SARS-CoV-2 inducing multiepitopic and cross-reactive humoral neutralizing and cellular CD4 and CD8 responses. Aparicio, B., y col. Emerg Microbes Infect. 2021 Dec;10(1):1931-1946. doi: 10.1080/22221751.2021.1978823.






Mu buen artículo. Enhorabuena. Una pregunta;
¿En qué se diferencia esta propuesta de la qué está llevando a cabo laboratorios Hipra?
Saludos