Tus propias bacterias serán las que sinteticen el agente terapéutico
desde el interior de tu intestino
Imagínate que un día
vas al médico y te receta que te tomes una pastilla repleta de bacterias intestinales
y que cada vez que te encuentres mal te bebas un vaso de agua en el que has
disuelto un fármaco. Y vas y te curas. Pues eso, que suena un poco homeopático
y a ciencia ficción, ocurrirá.
La microbiota es esa comunidad de
microorganismos buenos que viven en nuestro cuerpo sano, gracias a los cuales
podemos incluso disfrutar de una salud de hierro. Nos influyen mucho más de los
que te imaginas. Gracia a ellos se activan nuestras defensas y se mantienen a
raya a otros microorganismos patógenos, evitando que nos colonicen y causen
enfermedades. Nos ayudan además a hacer la digestión y nos proporcionan
vitaminas y otros compuestos que nosotros no podemos sintetizar y que son
necesarios para nuestra salud. Una buena microbiota es sinónimo de una buena
salud. Vivimos en equilibrio con nuestra microbiota y tenemos que cuidarla
porque cuando la maltratamos y ese equilibrio se pierde, nuestra salud se
resquebraja. Hay muchos ejemplos que relacionan la microbiota con la
enfermedad: desde alergias, diabetes, obesidad y enfermedades autoinmunes,
hasta Alzheimer, Parkinson y autismo, incluso el cáncer. Por eso, intentamos
manipular la microbiota intestinal con alimentos probióticos, prebióticos o
simbióticos, cada vez más sofisticados y mejor diseñados, e incluso
reemplazarla por completo mediante un trasplante de microbiota, el llamado trasplante fecal. Sin embargo, manipular la
microbiota es mucho más complicado que lo que podíamos imaginar. La razón es
que la microbiota es un complejo consorcio con millones de interacciones entre
los propios microbios y nuestras células, y todavía no entendemos bien los
mecanismos por los que la microbiota mantiene la salud o desencadena la
enfermedad.
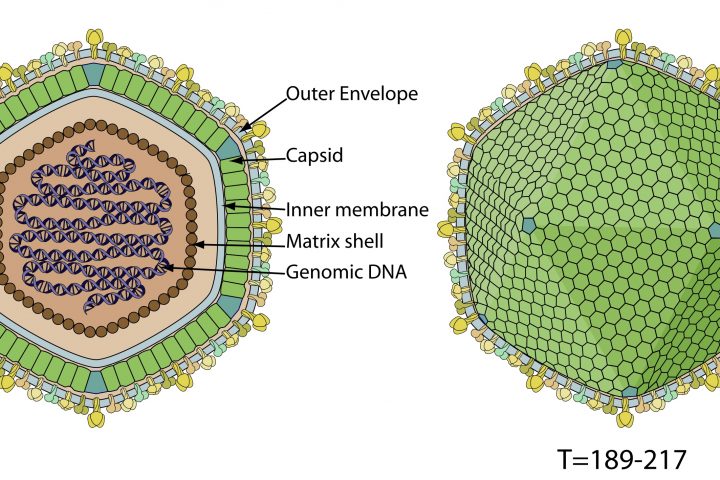
Una de las bacterias más
abundantes en el intestino
Si te digo que
menciones una bacteria presente en nuestro intestino seguro que piensas en
alguien como Escherichia coli. Y sí,
esta bacteria se aísla del intestino (de ahí lo del apellido “coli”, de “colon”), pero a pesar de ser tan
famosa, no es la más abundante. Casi el 90% de las bacterias intestinales
pertenecen a los grupos Bacteroidetes y Firmicutes, bacterias Gram negativas
anaerobios obligados. Y en concreto una de las más numerosas es la bacteria del
género Bacteroides.
 |
| Bacteroides spp. |
Nuevas herramientas genéticas
para manipular la microbiota intestinal
Si queremos
manipular la microbiota una posibilidad es modificar o manipular esta bacteria
tan abundante, pero el problema es que hasta ahora no se han desarrollado
herramientas que lo permitan. Sabemos manipular la expresión de los genes en Escherichi coli, quitarle un gen,
ponerle otro, modificarlo, … pero en otras bacterias anaerobias como Bacteroides, no es tan fácil (Los
promotores que regulan la expresión de los genes de Bacteroides son diferentes a los de otras bacterias, lo que hace
que muchos vectores de expresión no funcionen en esta bacteria).
Ahora, se han
publicado en la revista Cell un par
de artículos que describen nuevas
herramientas genéticas para manipular o “tunear” Bacteroides a nuestro antojo, desde hacerle que exprese una
nueva proteína, hasta encender o apagar la expresión de un gen in vivo cuando la bacteria está dentro
del intestino, simplemente tomando un inductor sintético en el agua de bebida.
Por una parte, los
investigadores (1) han desarrollado una construcción genética que integran en
el genoma de Bacteroides y que permite
a la bacteria sintetizar gran cantidad de una nueva proteína, aumentando en más
de 30.000 veces su producción. Además, comprobaron que esta modificación genética
no afecta a la estabilidad y viabilidad de la bacteria que sigue siendo capaz
de colonizar de forma eficaz el intestino y de producir dicha proteína in vivo dentro del intestino (del
ratón). Para comprobarlo, los investigadores introdujeron esa construcción
genética en seis especies distintas de Bacteroides.
En cada una de ellas la construcción genética producía una proteína
fluorescente diferente, de forma que cada especie bacteriana podía
diferenciarse una de otra por el color fluorescente. Infectaron ratoncitos de
laboratorio con una mezcla de las seis bacterias marcadas y dejaron que éstas
colonizaran el intestino. Al cabo de unos días, comprobaron que las seis había colonizado el intestino de
forma eficaz y se podían distinguir individualmente según el color fluorescente
(Figura 1). Esta nueva construcción genética abre la puerta a investigar la
función concreta de Bacteroides en la
microbiota in vivo, un paso más para
entender la compleja ecología del intestino.
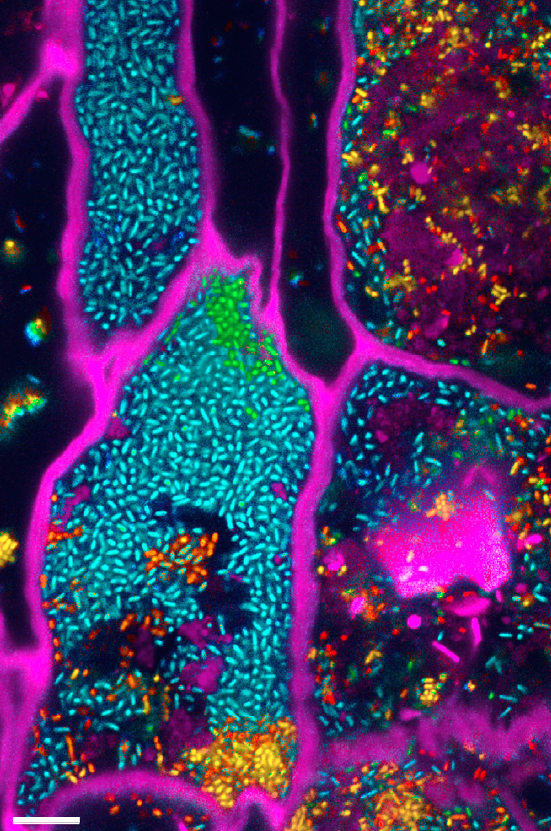
Figura 1. Detección simultánea in vivo de seis especies de Bacteroides. La imagen muestra una sección del colon del
ratón colonizado por seis especies de Bacteroides
modificadas genéticamente. Cada bacteria expresa una proteína fluorescente
diferente: azul, Bacteroides eggerthii;
naranja, Bacteroides ovatus; verde, Bacteroides thetaiotaomicron; rojo, Bacteroides fragilis; azul, Bacteroides uniformis; amarillo, Bacteroides vulgatus. (Fuente:
referencia 1).
Un interruptor para encender o
apagar genes en Bacteroides
En otro trabajo
simultáneo (2), los investigadores desarrollaron otra estrategia similar para
construir un vector genético que permita controlar la expresión de un gen en Bacteroides mediante un inductor
(sustancia química) sintético. Así, en
ausencia de ese inductor la expresión del gen se reprime totalmente, mientras
que la adición del inductor rápidamente activa el gen. Es como si fuéramos
capaces de encender o apagar un gen de Bacteroides, simplemente añadiendo o
quitando una determinada sustancia química.
Para esto, primero han
integrado en el genoma de Bacteroides
una nueva construcción genética que permite controlar la expresión de una
proteína dependiendo de la presencia de un análogo de la tetraciclina, la anhidrotetraciclina, que actúa como inductor.
Han empleado esta sustancia como inductor por varias razones: no está presente
ni en los medios de cultivo para crecer la bacteria Bacteroides, ni en el intestino u otros tejidos de los mamíferos,
ni en las dietas y alimentos que toman; además, la anhidrotetraciclina no es
tóxica para la bacteria, ni puede ser degradada o empleada como nutriente. Primero
comprobaron que el “interruptor” genético funcionaba perfectamente (Figura 2). Si
el gen que lleva la construcción es un gen esencial para la bacteria, ésta solo
sobrevive en presencia del inductor que “enciende” el sistema. Mientras que si
el gen inserto en la construcción es tóxico para la bacteria, ésta sobrevive en
ausencia del inductor, que “apaga” la expresión del gen.
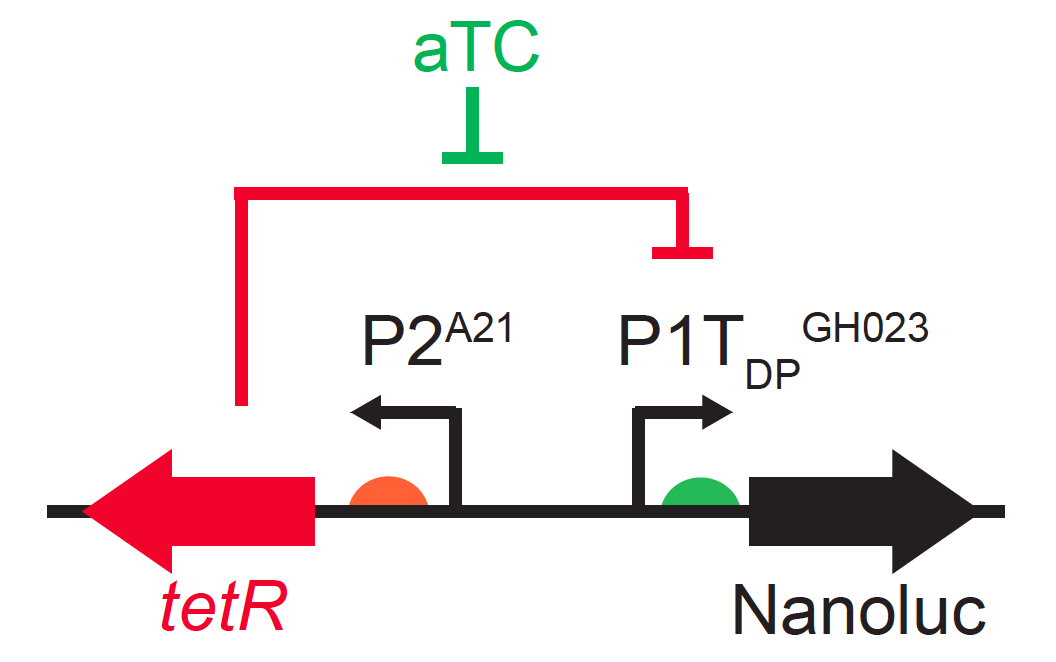
Figura 2. Vector de expresión para Bacteroides. ON: con inductor (aTC), se expresa el gen y
se produce la proteína Nanoluc (fluorescente). OFF: sin inductor, se apaga el
gen y no se sintetiza la proteína. (Fuente: referencia 2).
Lo alucinante es que este sistema funciona
perfectamente in vivo, dentro del ratón. Para comprobarlo,
añadieron Bacteroides modificados
genéticamente con el vector que expresa una proteína fluorescente a un grupo de
ratones. Comprobaron la presencia de esos Bacteroides
en el intestino y en las heces del ratón, y vieron que solo eran fluorescentes
cuando se les daba a los ratones el inductor anhidrotetraciclina en el agua de
bebida. O sea, que la bacteria había colonizado el intestino y producía la
proteína solo si en el agua de bebida estaba el inductor: podemos controlar desde fuera la expresión de una proteína por Bacteriodes que están dentro del
intestino. La fluorescencia aumentaba unas 4.800 veces en presencia del
inductor, y volvía a valores normales después de tres días de retirar el
inductor (Figura 3). Además, comprobaron que esto funcionaba en ratones con una
microbiota intestinal normal y completa y que no afectaba a la estructura
microbiana de la misma. Han comprobado también que el sistema funciona en
varias cepas distintas de cinco especies de Bacteroides
diferentes, por lo que puede ser empleado para modificar genéticamente un
amplio rango de bacterias del género Bacteroides.
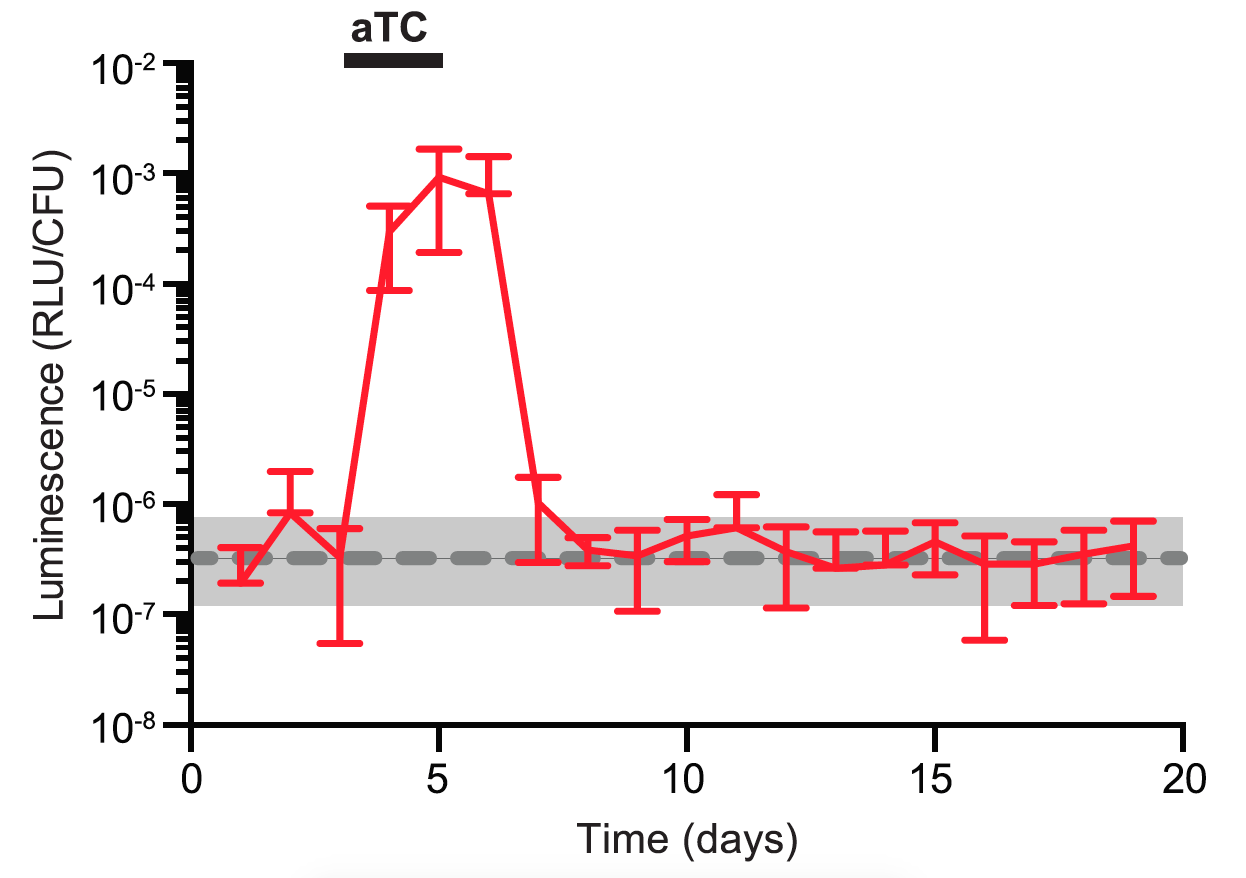
Figura 3. Control de la expresión de un gen
en Bacteroides dentro del ratón
mediante un inductor. La
cantidad de expresión del gen se mide por intensidad de la luminiscencia de las
heces del ratón a lo largo de los días que está colonizado por Bacteroides. El inductor aTC
(anhidrotetraciclina) se añadía en el agua de bebida durante tres días y luego
se retiraba. La línea discontinua corresponde a la fluorescencia en los ratones
controles en los que se les añadió la bacteria original sin el vector de
expresión. (Fuente: referencia 2).
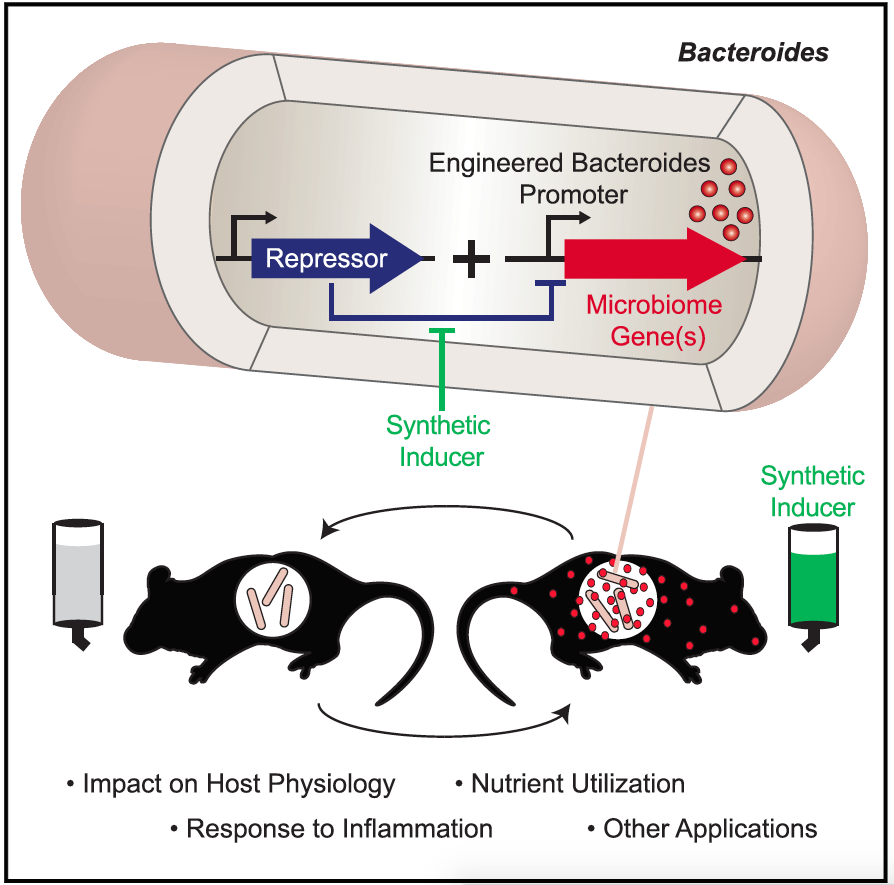
Esta construcción
genética permite controlar de forma precisa la expresión de un gen concreto en
la microbiota. Se podría proporcionar un agente terapéutico o una enzima
concreta bajo demanda in vivo desde
la propia microbiota intestinal, administrando el inductor en el aula de
bebida, en la dieta, en una cápsula de liberación retardada o incluso mediante
un enema. En el momento en el que te bebas el inductor, el Bacteroides que tienes en tu interior expresará el gen y liberará
la proteína o el agente terapéutico, sintetizado por tu propia bacteria. Nunca
la medicina ha sido tan personalizada.
 |
| (Fuente: referencia 2) |
(1). Tunable Expression Tools Enable Single-Cell Strain Distinction in the Gut Microbiome.
Whitaker WR y col. Cell. 2017.169(3):538-546.e12.
doi:
10.1016/j.cell.2017.03.041.
(2). Engineered Regulatory Systems Modulate Gene Expression of Human Commensals in the Gut. Lim
B y col. Cell. 2017. 169(3):547-558.e15.
doi:
10.1016/j.cell.2017.03.045.