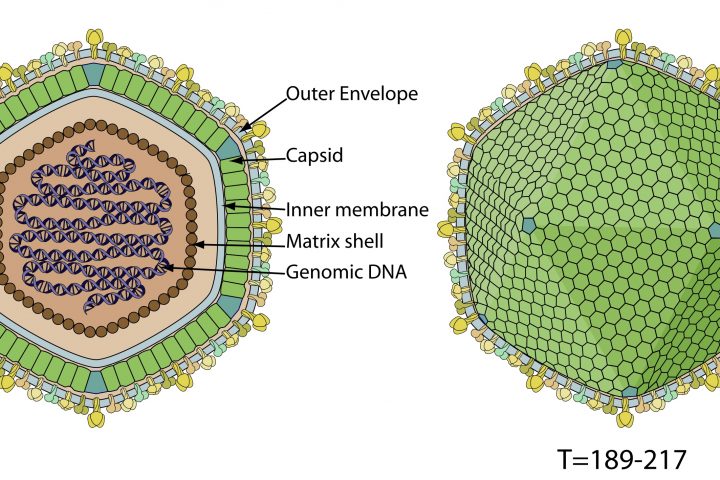
Ya se conocía la existencia de una pequeña proteína, denominada cyanovirina, capaz de neutralizar la entrada de algunos virus a las células. Esta proteína es producida por un microorganismo, las bacterias verde-azules o cianobacterias. Ahora, investigadores del California Institute of Technology han demostrado que mediante una sencilla técnica de ingeniería química pueden aumentar la actividad antiviral de esta proteína. Los resultados los han publicado en Proceedings of the National Academy of Sciences (PNAS).
Mediante la unión de dos cyanovirinas han hecho a la molécula mucho más potente para neutralizar el virus del SIDA, VIH. Las dos moléculas unidas son unas 18 veces más efectivas en prevenir la infección que la molécula sencilla. Estos pares o dímeros de cyanovirinas fueron estables y capaces de neutralizar hasta 33 subtipos diferentes del VIH, y fueron incluso más potentes que los siete anticuerpos anti-VIH más empleados actualmente para la neutralización del virus.
La cyanovirina se une a ciertos carbohidratos o azúcares que se encuentran asociados a las proteínas de la envoltura del virus, en concreto a la proteína gp120 que emplea en VIH para introducirse en el interior de las células. Una vez unida, la cyanovirina bloquea o evita que el virus infecte la célula, por un mecanismo todavía no del todo conocido.
Los investigadores también probaron a unir más moléculas de cyanovirina, para comprobar si tres o incluso cuatro moléculas juntas eran más efectivas, pero comprobaron que los mejores resultados se obtenían con dos moléculas juntas.
La cyanovirina no solo es activa frente al VIH sino que también neutraliza a otros virus con envoltura como el de la gripe, hepatitis C, herpes o Ébola. Por ello, esta nueva estrategia se podría emplear como futura droga terapéutica contra varias infecciones virales. De hecho, otros grupos ya están investigando su uso potencial en forma de geles o supositorios.
Designed oligomers of cyanovirin-N show enhanced HIV neutralization. Keeffe, J.R., et al. Proc Natl Acad Sci USA. 2011 Jul 28.