¿Puede ser Mycobacterium
tuberculosis un patógeno humano y un simbionte al mismo tiempo?
Mycobacterium tuberculosis es el agente causante de la tuberculosis, un viejo conocido del ser humano. Se calcula que actualmente un tercio de la población mundial tiene la enfermedad latente y, después del VIH, es el agente infeccioso que más gente mata: en el año 2001 contrajeron tuberculosis unos 8,8 millones de personas y 1,3 millones murieron.
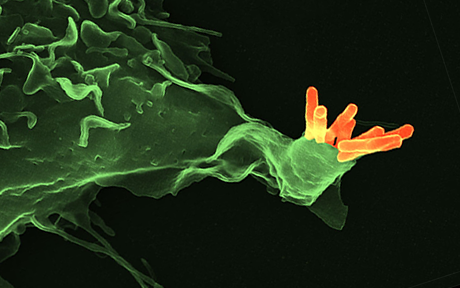
Mycobacterium tuberculosis (naranja) unido a la superficie de un macrófago (verde). Referencia: Kaufmann S.H.E. Nature. 2008 May 15;453: 295-6. Figura: Volker Brinkmann, Core Facility Microscopy, Max Planck Institute for Infection Biology, Berlin.
Más de 2.000 millones de personas están infectadas por Mycobacterium tuberculosis, pero «solo» causa unos 1,3 millones de muertes cada año
El permanecer latente en el organismo es una de las características de la tuberculosis humana. La
mayoría de la gente infectada con Mycobacterium desarrolla una respuesta inmune que controla la replicación de la bacteria, desarrollando un infección persiste sin síntomas de la enfermedad. Se ha sugerido incluso que la latencia de Mycobacterium puede suponer un estimulo beneficioso del sistema inmune de la persona infectada, que le protegería frente a otras posibles infecciones. En realidad la enfermedad se reactivará y se manifestará en sólo una pequeña cantidad de personas infectadas, frecuentemente varias décadas después de la infección inicial. Controlar la replicación de la bacteria y mantenerla latente es, por tanto, una forma de que el huésped evite la virulencia del patógeno. Sin embargo, la latencia también podría haber evolucionado como una estrategia del patógeno para asegurar su propia transmisión y evitar su extinción en poblaciones pequeñas de personas. En este sentido, Mycobacterium ha desarrollado varios mecanismos para sobrevivir durante la latencia dentro del huésped.
Por esta razón, la latencia parece ser el resultado de una co-evolución o evolución conjunta del huésped y del patógeno, de la interacción entre los dos. Los cambios evolutivos en el patógeno para aumentar su infectividad han sido contrarrestados por cambios evolutivos en el huésped para incrementar la resistencia a la infección. A lo largo de la evolución, el patógeno ha regulado su virulencia para hacer posible su persistencia y difusión en las poblaciones humanas que cada vez aumentaban en densidad y resistencia a la infección. Por una parte, la bacteria ha tenido que evolucionar para poder resistir al sistema inmune del huésped, pero manteniendo su capacidad de transmitirse en la población y no extinguirse. Para que la bacteria pueda transmitirse es necesaria la enfermedad, algo que depende también de la densidad de la población.
El complejo Mycobacterium tuberculosis está formado por un grupo de especies y sub-especies bacterianas que comparten entre sí más de 99% de identidad genética, pero que se diferencian en el rango de huésped primario, es decir, en el tipo de animal que infectan. Algunas especies infectan al hombre, otras están adaptadas exclusivamente a los animales
Las formas adaptadas al ser humano son Mycobacterium tuberculosis (en sentido estricto) y
Mycobacterium africanum, esta última de menor virulencia. Los análisis filogenéticos de las mycobacterias humanas demuestran que existen varios linajes que divergen de un mismo ancestro común y que se diversifican en distintas regiones geográficas.
Existen varios linajes de Mycobacterium tuberculosis que se diversifican en distintas regiones geográficas
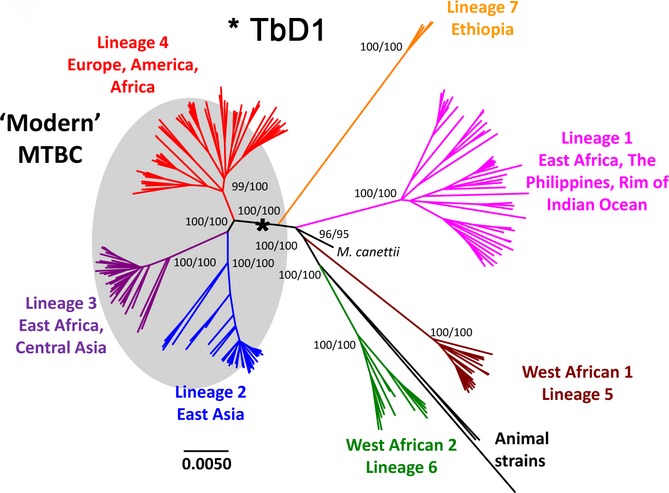
Análisis filogenético de 220 cepas del complejo Mycobacterium tuberculosis (ref. 1)
Un grupo está formado por las cepas más “modernas” e incluye tres linajes separados: linaje 4
(Euro-Americano), linaje 2 (este asiático) y el linaje 3 (este de África y Asia central). Las cepas de los linajes 2 y 4 son responsables de la mayoría de los casos de tuberculosis humana que ocurren actualmente en el mundo, y de los brotes de tuberculosis multirresistente a los antibióticos. Esto puede ser un reflejo de su éxito evolutivo y de que son linajes mejor adaptados al ser humano actual.
Las cepas más “antiguas” incluye los linajes 1 (Indo-Oceánico), los linajes 5 y 6 de Mycobacterium africanum (oeste de África) y el linaje 7 (Etiopía). El linaje 1 parece ser el más antiguo. Las cepas de los linajes modernos son más virulentas que las de los linajes antiguos.
A diferencia de las adaptadas al hombre, las mycobacterias adaptadas a los animales son capaces de establecer infecciones y de transmitirse entre especies distintas de animales. Las mycobacterias aisladas de animales son: Mycobacterium microti (en ratones, topillos, musarañas y gatos), Mycobacterium
pinnipedii (en focas y leones marinos), Mycobacterium caprae (en cabras y ciervos), Mycobacterium
bovis (en ganados y otros animales domésticos y salvajes), Mycobacterium orygis (en oris, gacelas, venados, antílopes, búfalos, …), Mycobacterium mungi (en mangostas), y Mycobacterium suricattae (en suricatas). También se han asilado mycobacterias de chimpancés salvajes. Todas estas cepas parecen tener un mismo origen y están relacionadas con los linajes 5 y 6 de Mycobacterium africanum.
Mycobacterium tuberculosis no se originó a partir de Mycobacterium bovis
Hace años se pensaba que los humanos habíamos adquirido el bacilo de la tuberculosis durante el Neolítico partir del ganado durante la domesticación de los animales, y que, por tanto, Mycobacterium tuberculosis provenía de Mycobacteriumbovis. En realidad el origen es el contrario. Los análisis genómicos demuestran que Mycobacterium bovis ha perdido varios genes todavía presentes en Mycobacterium tuberculosis, y que por tanto las especies adaptadas al hombre son anteriores y más antiguas que Mycobacterium bovis y otras mycobacterias animales, que surgieron posteriormente.
El hecho de que los linajes africanos y las cepas animales sean los de mayor diversidad genética sugiere que el origen de Mycobacterium está en África. La mayoría de los linajes animales afectan a animales salvajes africanos, mientras que los linajes adaptados a animales domésticos están más repartidos, probablemente como consecuencia de las migraciones humanas y del comercio.
El origen común (monofilético) y la marcada distribución geográfica de las cepas de Mycobacterium sugiere que estas bacterias podrían haber acompañado a las primeras migraciones humanas en su salida de África y haberse diversificado conjuntamente con las poblaciones humanas. Sin embargo, parece que algunos linajes son más “generalistas” y son capaces de persistir en diferentes poblaciones humanas, mientras que otros son más “especializados” y solo persisten en determinadas poblaciones.
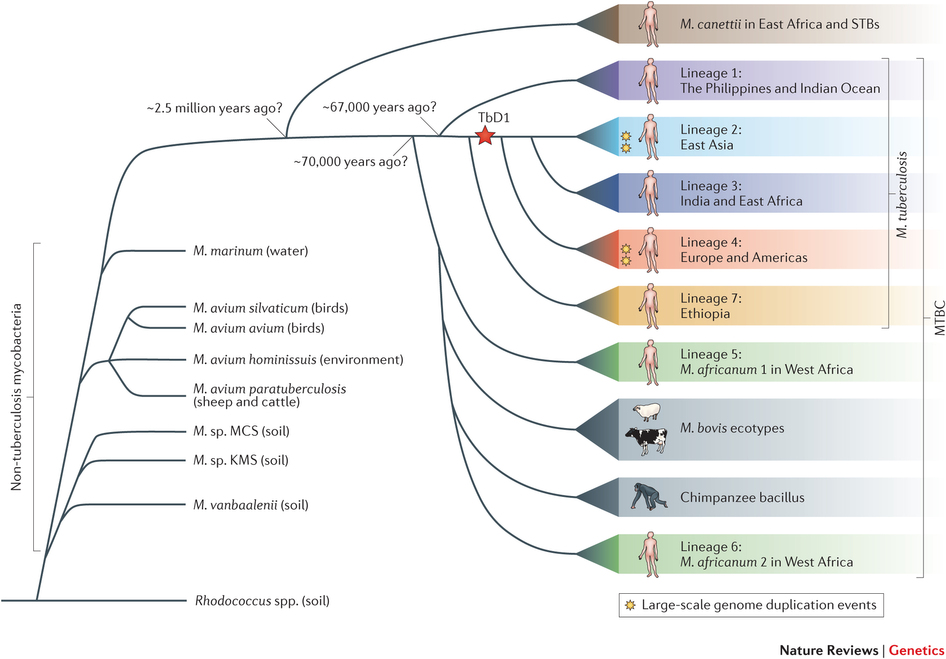
Relaciones evolutivas entre miembros del complejo Mycobacterium tuberculosis (ref. 2)
El origen de la tuberculosis humana es africano
Los estudios de las filogenias de genomas de distintos linajes de Mycobacterium permiten estimar
que la edad del ancestro común a todo el complejo Mycobacterium es de unos 73.000 años. Los datos sugieren que el linaje 1 se separó del resto hace unos 67.000 años, coincidiendo con la primera migración humana de África. Los linajes 2 y 4 se separaron hace unos 30.000-46.000 años y 32.000-42.000 años, respectivamente, lo que se correlaciona con la primera evidencia arqueológica
de presencia de humanos modernos en Europa y este de Asia, respectivamente. Mycobacterium bovis se separó de una rama relacionada con Mycobacterium africanum (linajes 5 y 6). Los linajes 2, 3 y 4 comparten todos ellos una misma deleción, TbD1.
También existen datos de restos arqueológicos de lesiones óseas consistentes con infecciones por tuberculosis y evidencias moleculares de la presencia de genoma de la bacteria en dichos restos. La evidencia molecular más antigua es la presencia de DNA de Mycobacterium en huesos de bisonte de hace 17.500 años encontrado en Wyoming (EE.UU.). También se ha encontrado DNA de la bacteria en esqueletos humanos de hace 9.000 años en Israel, otros de hace unos 7.000 años encontrados en Alemania, y en momias egipcias de 4.000 años de antigüedad. La presencia de DNA de Mycobacterium en momias peruanas de hace unos 1.000 años también se demostró recientemente (ver El origen de la tuberculosis en América, en microBIO).
Quizá, como hemos dicho al principio, la co-evolución del patógeno y el ser humano ha sido en parte beneficioso para ambos. La infección latente por Mycobacterium ha podido generar una cierta protección inmunológica frente a otros patógenos. Afirmar que la tuberculosis ha podido ser beneficiosa para la humanidad no deja de ser algo arriesgado y paradójico si tenemos en cuenta que esta bacteria es responsable de cerca de 1,3 millones de muertes cada año, pero se calcula que más de 2.000 millones de personas pueden tener una infección latente que nunca se manifestará como enfermedad, algo que la evolución ha mantenido a lo largo de miles de años. Cabe preguntarse entonces si Mycobacterium tuberculosis puede considerarse un patógeno o un simbionte.
(1) Co-evolution of Mycobacterium tuberculosis and Homo sapiens. Brites D, Gagneux S. Immunol Rev. 2015. 264(1):6-24. doi: 10.1111/imr.12264.
(2) Genomic insights into tuberculosis. Galagan JE. Nat Rev Genet. 2014. 15(5):307-20. doi: 10.1038/nrg3664.









Muy interesante. Csualmente escribí sobre este tema en mi blog en septiembre 2013:
https://abordonseng.wordpress.com/2013/10/05/mycobacterium-tuberculosis-the-pathogen-bacterium-that-is-with-us-since-we-left-africa/
Muy interesante, muchas gracias por compartir!
Ignacio
Felicitaciones, muy buen artículo. Hay evidencias que la co-evolución patógeno hospedero puede ocurrir también en diversas enfermedades infecciosas. La variabilidad antigénica, variación de fase, son parte de ello. ¡Que sigan las investigaciones genómicas y sobre microbiología molecular en general para aportar más conocimientos al respecto!.
Muchas gracias por tu comentario!
Felicidades por este articulo tan completo!
Gracia a ti!
Excelente artículo, ¡enhorabuena!
Excelente artículo, ¡enhorabuena!
Los avances en biología molecular…sigue desentrañando paradigmas.
Muy interesante la co-evolución huésped-patógeno
Qué interesante, práctico, didáctico y muy útil sobre todo!!! Me pidieron hablar sobre Microbacterias atípicas…y me sirve de sobre manera Dr. Ignacio. Muchas gracias!!!