(tiempo aproximado de lectura: 11 minutos)
Cómo funcionan y para qué sirven los test de diagnóstico del coronavirus: sensibilidad, especificidad, falsos positivos, falsos negativos
Lo dijo la OMS ya hace unas semanas: test, test, test
Durante una infección, el virus se multiplica activamente. Cuando comienza, el virus se puede detectar en muestras biológicas (frotis faríngeo o nasofaríngeo, aspirado traqueal o lavado broncoalveolar). Primero hay un período de latencia en el que todavía no es posible detectar la respuesta de tu sistema inmune. Pero después de unos días, comienzas a producir anticuerpos. Se producen primero anticuerpos del tipo IgM hasta alcanzar un máximo a los 7-10 días para, más tarde, casi desaparecer. Esta respuesta primaria es indicativa de una infección aguda. Posteriormente se producirá la respuesta inmune secundaria, más rápida, intensa y prolongada. Se producirán anticuerpos de tipo IgG y durarán más tiempo en la sangre. Además, a nivel de las secreciones mucosas, como las respiratorias, juega un papel predominante la IgA.
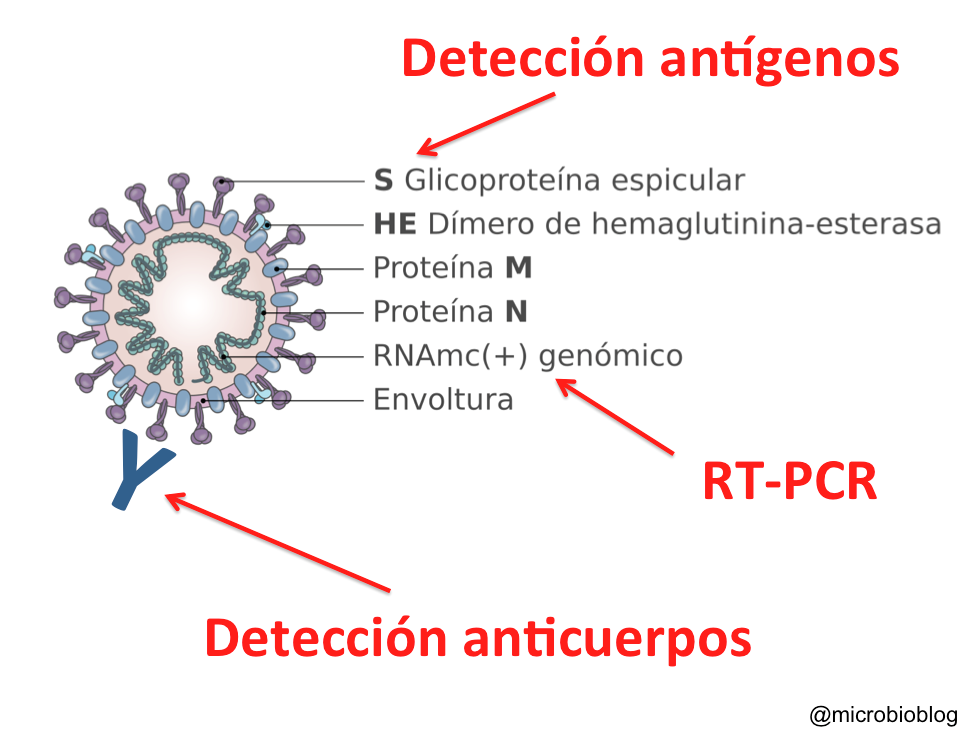
Para detectar la presencia del virus (detección directa) podemos emplear dos tipos de test: la PCR que detecta el genoma del virus o los test inmunológicos que detectan las proteínas (antígenos) del virus. El tercer tipo de test es el que detecta los anticuerpos que produces como respuesta a la infección, son los test serológicos de detección indirecta del virus. Aunque hay varias modalidades de cada uno de estos tipos de test, vamos a explicar brevemente cómo funcionan.
Detectar el genoma del virus: la RT-PCR
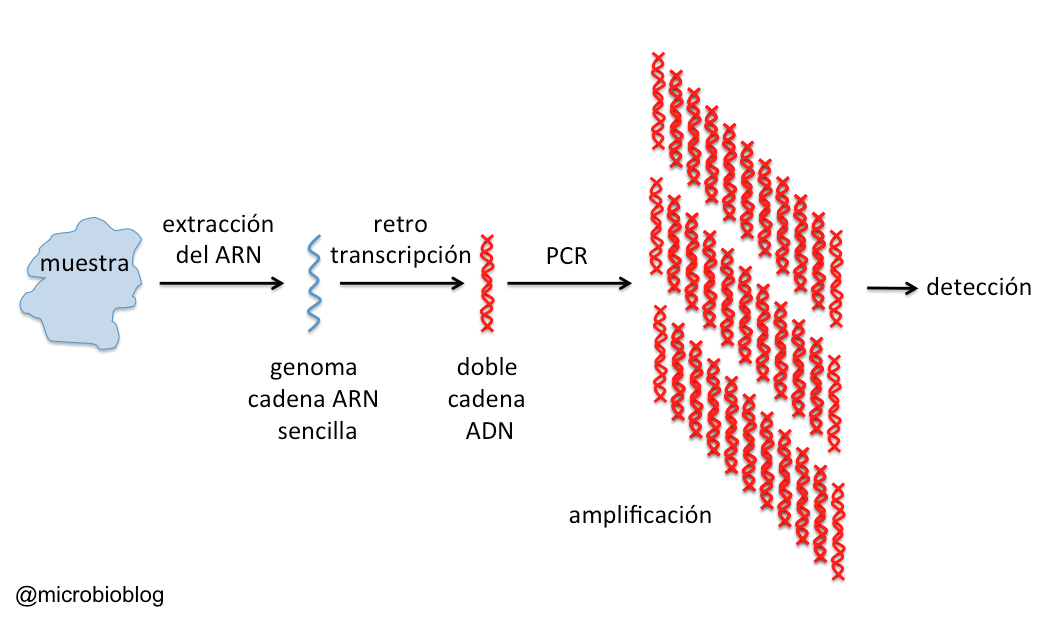
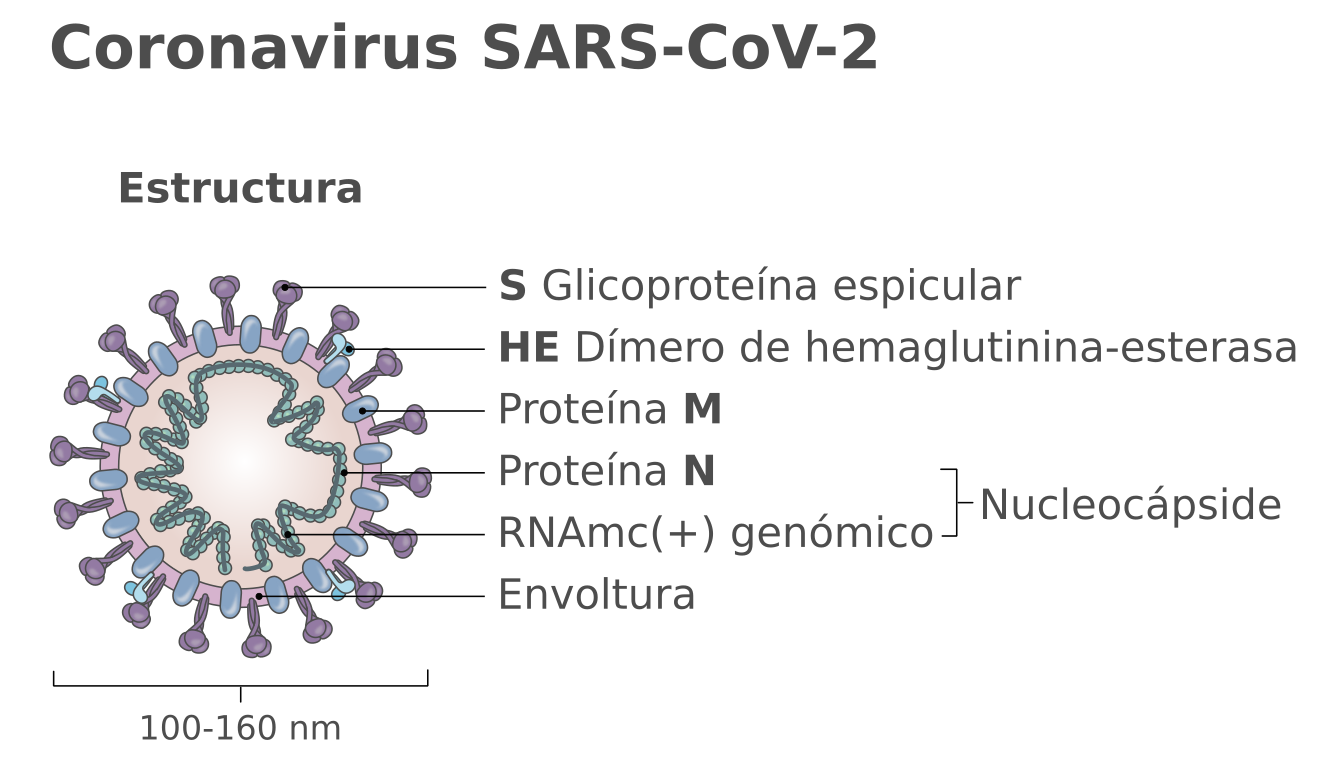
El genoma del coronavirus SARSCov2 es una molécula de ARN monocadena de unos 30 kilobases. Una vez tomada la muestra (el frotis nasofaríngeo o aspirado más profundo), lo primero que hay que hacer es extraer el genoma del virus. Esto normalmente se hace mediante un kit de extracción de ácidos nucleicos. Así, además de inactivar el virus, obtenemos su genoma ARN. A continuación, hay que copiar ese ARN en forma de ADN. Eso se hace con otro kit que emplea una enzima que se denomina transcriptasa inversa o Retro Transcriptasa (de ahí el “RT”, del nombre RT-PCR). Luego, el genoma del virus en forma de ADN se amplifica mediante la Reacción de la Polimerasa en Cadena (PCR, en inglés. Ojo, aquí PCR no significa “proteína C reactiva”). Esta amplificación consiste en hacer millones de copias de un fragmento del ADN, de forma que podamos “visualizarlo” o detectarlo mediante un sistema concreto. El sistema de PCR a tiempo real permite incluso cuantificar la muestra, es decir, saber cuántas copias del virus tenemos por mL.
Si la reacción es positiva, demuestra que había ARN del virus, es decir que la persona estaba infectada.
Como lo primero que obtuvimos del virus fue su genoma, este tipo de pruebas son las primeras que se desarrollaron. De hecho desde el 13 de enero, la OMS ya publicó el primer protocolo. Normalmente, se suelen realizar dos ensayos: uno de cribado o screening y un segundo confirmatorio. Incluso se puede hacer un tercero adicional de confirmación. Estos tres ensayos de RT-PCR se diseñan para detectar tres genes distintos del virus.
Estos test de PCR son muy específicos y sensibles. Suelen tardar en realizarse unas cuantas horas. Requieren un equipamiento y un personal técnico especializado. Pueden dar resultado positivo en personas antes de que manifiesten síntomas, pero que ya tengan el virus. A lo largo de la enfermedad pueden permitir hacer un seguimiento de cómo va la infección, porque cuando la persona ya se ha curado y no tiene el virus activo, en principio debería dar negativo. No se puede descartar que pacientes convalecientes “sin síntomas” puedan dar positivo en la RT-PCR y seguir siendo portadores del virus.
Detectar las proteínas del virus: test antigénicos
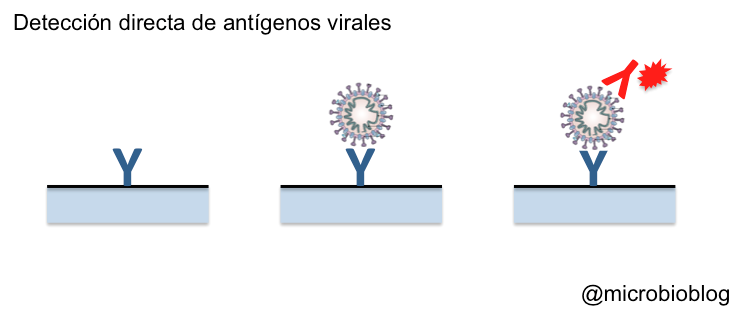
Otra forma de confirmar la presencia del virus es detectar sus proteínas o antígenos. Hay distintas técnicas o soportes sobre los que hacer este tipo de test, pero en definitiva más o menos todos tienen el mismo fundamento. Sobre un soporte se fijan anticuerpos específicos que reaccionarán contra alguna proteína del virus. En este caso es contra las proteínas de la superficie de la envoltura (proteína S), las que se proyectan hacia el exterior y forman esas espículas que dan el nombre a este tipo de virus, corona-virus. Si en la muestra (las mismas que para la RT-PCR) hay partículas virales, éstas quedarán fijadas al anticuerpo. Es como si el virus hubiera sido capturado por el anticuerpo. A continuación, se añade un segundo anticuerpo contra el virus de manera que se forme un emparedado o “sándwich”: anticuerpo-virus-anticuerpo. Este segundo anticuerpo estará marcado o señalado de alguna manera para poner de manifiesto la reacción.
Si la reacción es positiva, demuestra que había proteínas del virus, es decir que la persona estaba infectada.
Este tipo de test basado en la detección de moléculas es muy habitual en diagnóstico clínico. Su fundamento es el mismo que las tradicionales pruebas de detección de drogas o los test de embarazo. En el caso que nos ocupa, tardó en aparecer en escena porque se requiere el empleo de anticuerpos de captura específicos frente a este virus concreto. La ventaja es que son mucho más rápidos, y según el tipo de soporte, se pueden realizar en unos pocos minutos. No necesitan un equipamiento especifico ni un personal técnico altamente cualificado. Son más baratos. La desventaja es que son mucho menos específicos y sensibles que la RT-PCR.
Un comentario adicional a ambos test de detección directa del genoma o de las proteínas del virus: que la reacción sea positiva no implica que el virus esté activo y sea infectivo. Es decir, podemos detectar su genoma o sus proteínas pero que el virus no esté completo, es decir, podemos estar detectando “restos” del virus.
Detectar anticuerpos frente al virus: test serológicos
La tercera aproximación consiste en detectar la respuesta inmune frente al virus, los anticuerpos. Es una detección indirecta, no detectamos el virus sino que ponemos de manifiesto la respuesta inmune frente a él. En este caso la muestra que vamos a emplear es una gota de sangre, porque vamos a detectar los anticuerpos que has generado contra el virus.
De nuevo, hay distintas técnicas o soportes sobre los que hacer este tipo de test, pero más o menos todos tienen el mismo fundamento. En este caso, sobre el soporte se fijan proteínas del virus, normalmente las proteínas más expuestas hacia el exterior, como la proteína S de la envoltura. Esto es así porque nuestro sistema inmune lo primero que reconoce es lo que está más hacia el exterior del virus. Como con este test queremos detectar los anticuerpos que producimos, la muestra será una simple gota de sangre. Si en la muestra hay anticuerpos contra el virus, se pegarán y quedarán fijados a las proteínas del virus. A continuación, se añade un segundo anticuerpo contra el anticuerpo humano: estos suelen ser anticuerpos de otro animal que reaccionan contra nuestros propios anticuerpos, porque los anticuerpos humanos en realidad actúan como antígenos en otros animales. Se forma así un trío: proteínas del virus-anticuerpo humano-anticuerpo de otro animal. Este segundo anticuerpo estará marcado o señalado de alguna manera para poner de manifiesto la reacción.
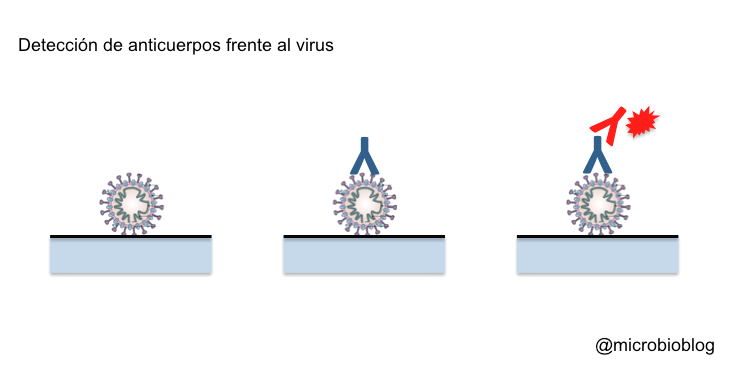
Si la reacción es positiva, demuestra que había anticuerpos contra el virus, es decir, que la persona en algún momento ha estado en contacto con el virus y su sistema inmune ha reaccionado produciendo anticuerpos. Esto no implica necesariamente que esté infectado, quizá se ha curado, o simplemente ha estado en contacto con el virus y no ha tenido síntomas.
Este tipo de test también se ha desarrollado después que los de RT-PCR, cuando ya hemos tenido suero de pacientes que han pasado la enfermedad. También, tienen la ventaja de que son mucho más rápidos que la PCR, y según el tipo de soporte, se pueden realizar en menos de pocos minutos. No necesitan un equipamiento especifico ni un personal técnico altamente cualificado. Son más baratos. La desventaja es que son mucho menos específicos que la RT-PCR. Otra importante desventaja de este tipo de test es que nuestro organismo necesita varios días para producir anticuerpos detectables. O sea, que una persona puede estar infectada pero durante los primeros días no dar positivo en este tipo de test.
Algunos test de anticuerpos pueden distinguir el tipo de inmunoglobulina: si es IgM, indicativo de una infección reciente, o IgG, indicativo de una respuesta secundaria, y por tanto, más prolongada.
Sensibilidad y especificidad
Cuando queremos estudiar el rendimiento o lo efectivo que es un test diagnóstico lo que hacemos es comparar el resultado de ese test en un grupo control de individuos que sabemos a ciencia cierta que están sanos o están infectados. Esto normalmente se hace comparando nuestro test con otro que se considera el patrón de referencia (gold standard). Con estos resultados se construye la tabla que nos muestra la distribución de sanos y enfermos y el resultado del test.
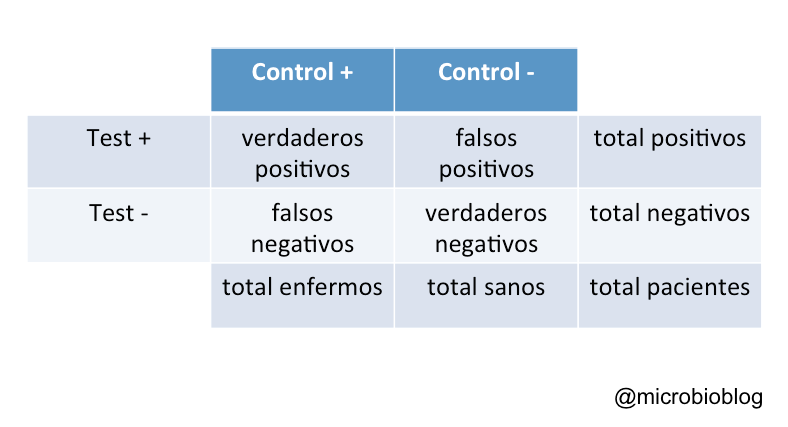
Así, podemos clasificar los pacientes como verdaderos positivos, verdaderos negativos, falsos positivos (no están infectados pero el test es positivo) y falsos negativos (están infectados pero el test es negativo). Con estos datos podremos calcular la sensibilidad y la especificidad de nuestro test.
La sensibilidad del test representa la probabilidad de clasificar correctamente a los infectados o, lo que es lo mismo, a los verdaderos positivos. Una sensibilidad alta significa pocos falsos negativos. Es una proporción en la que en el denominador se sitúa el total de infectados y en el numerador los positivos verdaderos:
Sensibilidad = verdaderos positivos / total de infectados
Por su parte, la especificidad de un test representa la probabilidad de clasificar correctamente a los sanos o, lo que es lo mismo, a los verdaderos negativos. Una especificidad alta significa pocos falsos positivos. Es una proporción en la que en el denominador figuran el total de sanos y en el numerador los negativos verdaderos:
Especificidad = verdaderos negativos / total de sanos
Para entenderlo mejor, vamos a poner un ejemplo. Supongamos que tenemos una población de 100 individuos y queremos valorar la utilidad de la RT-PCR para el diagnóstico de la enfermedad por el coronavirus. En este caso seleccionamos el historial clínico (analítica, radiografías, etc.) como el patrón de referencia (asumiendo que esos datos no fallan nunca a la hora de clasificar sanos y enfermos y diagnosticar la COVID-19) y realizamos la RT-PCR a los 100 individuos. Los datos clínicos nos indican que 30 de los 100 tienen la enfermedad de COVID-19: hay 70 sanos y 30 enfermos.
Al realizar la RT-PCR a las 100 individuos podríamos obtener los siguientes resultados (insisto que es un ejemplo ficticio):
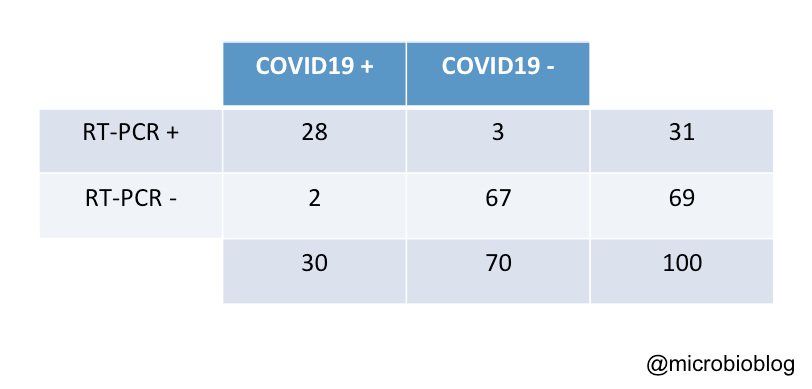
Según esto, la sensibilidad de nuestro test de RT-PCR es del 93% (28/30) y la especificidad del 96% (67/70).
Uno de los problemas de estos parámetros es que la sensibilidad nos dice la probabilidad de clasificar correctamente al enfermo una vez que sabemos que está enfermo. Por su parte, la especificidad nos dice la probabilidad de clasificar correctamente al sano pero una vez que ya conocemos que está sano. Pero esto en la práctica, muchas veces, lo desconocemos. Cuando un test diagnóstico tiene tanto la sensibilidad como la especificidad cercanas al 100% se comporta como un test de referencia y por lo tanto sus resultados serán casi siempre válidos. Sin embargo, esta circunstancia es excepcional, muy pocas veces un test es 100% sensible y específico. La sensibilidad de la RT-PCR suele ser alta, alrededor de un 95%, y la de los test serológicos de un 70%. Por eso, se suelen emplear varios test diagnósticos al mismo tiempo, porque nos darán más información de la situación real.
Un pregunta que nos podemos hacer es ¿por qué a veces los test dan resultados falsos? Las causas son múltiples. Los falsos negativos pueden ser debidos: en el caso de la RT-PCR, a que la cantidad de virus o de muestra sea escasa, la liberación de los mismos sea intermitente, no se haya tomado bien la muestra, que no se haya extraído correctamente el genoma del virus, fallo en los reactivos o inhibición de la reacción; en el caso de los test serológicos, que la muestra se haya obtenido durante el periodo ventana en el que todavía no se hayan producido los anticuerpos, fallos en los reactivos del test, o baja sensibilidad.
Los falsos positivos pueden ser debidos: en el caso de la RT-PCR, a contaminación en el procesamiento de las muestras o reacción cruzada con otros virus, incluso fallo en el etiquetado; en el caso de los test serológicos, reacción a otros virus.
¿Qué información nos puede dar la combinación de la RT-PCR y la detección de anticuerpos?
El test de RT-PCR nos indica la presencia del virus, quién está infectado en ese momento. Los test de detección de anticuerpos nos indican quién estuvo infectado y quizá está inmunizado, al menos durante un tiempo, contra el coronavirus. Según esto, y con todas las reservas según la sensibilidad y especificidad de cada test, si combinamos resultados de RT-PCR, con detección de anticuerpos (IgM e IgG) se podría plantear lo siguiente:
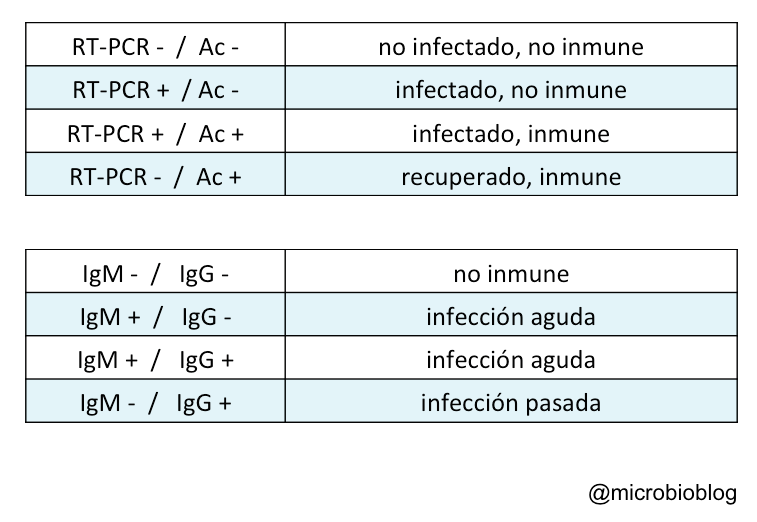
Sin embargo, este planteamiento es una simplificación y tiene sus limitaciones. El que no detectes anticuerpos puede no significar que no estés inmunizado. En el caso de infecciones por virus, que son intracelulares, la inmunidad celular no mediada por anticuerpos es tan importante o más que la mediada por anticuerpos. Es decir, en ocasiones, no hay anticuerpos pero el individuo puede estar “inmunizado”.
A pesar de ello, todo esto nos puede ayudar a controlar y monitorizar la epidemia en las próximas semanas, conocer cuántas personas han estado en contacto con el virus y están inmunizadas, a definir con mayor exactitud las tasas de letalidad del virus, predecir que podrá ocurrir si hay una segunda «oleada» del virus y a decidir las medidas y la velocidad del desconfinamiento que todos estamos deseando.
NOTA:
Otro anticuerpo que tiene un papel predominante en las secreciones mucosas, como la respiratoria, es la IgA. En este sentido ya existen test para detectar IgA que parecen tener una mayor sensibilidad que los test para IgM o IgG.
Actualización (19/04/2020):
Para aclarar algunas preguntas, adjunto algunas tablas y diagramas sobre posible interpretación de resultados de la RT-PCR, y anticuerpos IgM, IgG. Os recuerdo que siempre habrá que tener en cuenta también los datos clínicos y que, ante la duda, los test se deberían repetir para confirmar.
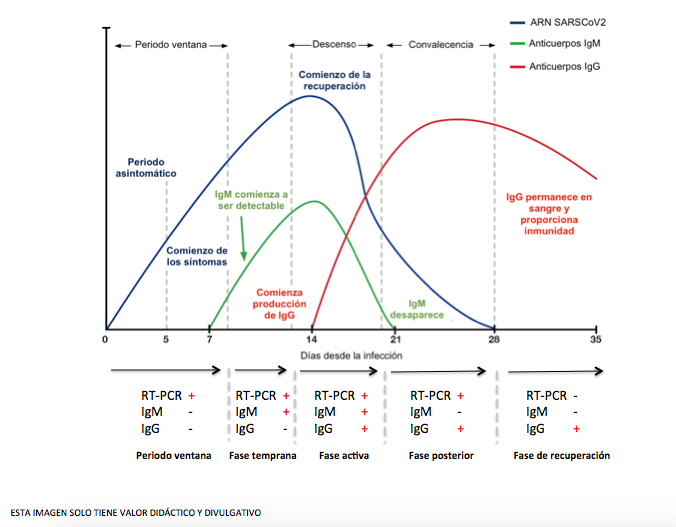
Evolución de la concentración de ARN, IgM e IgG
a lo largo de la enfermedad:
Protocolo de diagnóstico de la COVID19 (Fuente @Salud_JCYL):

Interpretación de los resultados de la PCR y anticuerpos:
Interpretación de las pruebas diagnósticas frente las SARS-CoV-2 (Ministerio de Sanidad)
AVISO: este blog es de divulgación científica, su objetivo es la difusión de la ciencia, no es un consultorio clínico. Yo no soy sanitario. Las consultas particulares sobre temas clínicos deben hacerse al médico. Las consultas sobre los resultados particulares de las pruebas de diagnóstico y sobre cómo interpretarlos deben hacerse al médico o al servicio que te las haya hecho.





Brutalmente bien explicado. Gracias por digerir toda esa información científica y difundirla en un lenguaje sencillo
Muchísimas gracias. Es de gran utilidad.
Costos en $, más o menos
Magnífica explicación, sobre todo para los que somos profanos curiosos. Me surge una duda con respecto al test RT-PCR: ¿cómo se sabe que los genes que se detectan son específicos del virus en cuestión? O, preguntado de otra manera: ¿podría ser que se detectase material genético de otros virus o de células del propio cuerpo que coincidiese con el del virus que se busca? Muchas gracias por la atención y, de nuevo, por las explicaciones.
Fernando
Primero, antes de hacer el RT-PCR, las muestras se tiene que tratar con un kit para degradar el ADN que pueda haber y que sólo quede ARN.
En segundo lugar, se conoce la secuenciaciación genómica del virus, entonces se pueden diseñar unas pequeñas bases de genoma (llamados 'Primers' en inglés) que se utilizan para detectar el genoma del virus presente en la muestra. Éstos hibridarán y serán la base para transformar ese ARN del virus a ADN (que es la base de esta prueba RT-PCR). Así te aseguras que de todo lo presente en la muestra, sólo detectas y amplificas lo que quieres buscar.
Para poder amplificar el ADN resultante de la conversion ARN ->ADN, necesitas poner unos moldes (llamados primers como ha dicho el anterios usuario). Como bien apuntas, si esos moldes no son especificos de este virus en concreto, no habria forma de saber si el ADN amplificado (el que detectamos) pertenecen al COVID o a otro virus o incluso al host (nosotros). Por eso los moldes que se utilizan, se diseñan basandonos en la secuencia de ARN/ADN especifica del virus, es decir, diseñamos unos moldes que sabemos que solo podran ajustarse a la secuencia ARN/ADN del COVID. Seria algo asi como usar una huella dactilar parcial para a partir de ahi desenmascarar al individuo.
Que bueno!!!!
Muchas gracias Nacho!! abrazo
Explicado súper bien para q los q no sabemos mucho de esto podamos entenderlo
Muy buena explicación. Lo he recomendado leer a mis conocidos
Es una excelente explicación. Mi hija de segunda de Bachillerato lo ha entendido.
Estupenda la explicación de los diferentes tipos de test y de ahí la importancia de realizarlos a las poblaciones de riesgo ya, si queremos controlar esta pandemia y además no quetemos cargarnos la economía del pais.
Muy interesante el artículo para hacernos ver lo importante que es realizar test a toda la población de riesgo ( personal sanitario, sociosanitario, fuerzas de orden publico, ancianos que conviven residencias de mayores,etc ) para controlar esta pandemia y evitar el colapso económico del país ya que no hemos podido evitar el colapso sanitario en las zonas epicentro de la pandemia en España (Madrid y Barcelons )
Gracias
gracias, realmente útil para entender la dificultad resultados reales.
Muchas gracias.
Explicación muy didácticas de conceptos esenciales.
Buen trabajo explicando todo. Comparto.
Yo también estoy interesada en saber cuanto cuesta un test de confianza y si lo puede adquirir un particular en la farmacia o sea donde lo puedo comprar yo??
Muchas gracias,yo llevo varios días intentando aclarar estas diferencias y resulta complicado.
Muy buena y comprensible explicación.
Gracias.
Muy bien explicado
A ver si los "expertos" se lo explican a los políticos y toman nota de una vez
En los falsos negativos cuanto dias u horas es el periodo de ventana? y en que dia del contacto es ideal realizar la prueba
Excelente exposición. Muchas gracias
Hola Fernando,
Respondiendo a tus preguntas "se puede detectar material genétivo de otros virus o de células del propio cuerpo? Empiezo por esta y la respuesta es no. Y pq? Ahí te puedo responder a tu primera pregunta. Una de las primeras cosas que se hizo es secuenciar el genoma del virus, base nitrogenada a base nitrogenada. En la técnica de RT-PCR o cuando se hace una PCR normal, una vez se conoce la secuencia del virus, se diseñan lo que se llaman primers que son unas secuencias cortitas de nucleótido que son complementarios al genoma que tú quieres amplificar. Además, lo que se hace es comparar la secuencia del virus con la de otros virus e incluso genoma humano. Así puedes ver si hay coincidencia génica. Si la hay, es imposible que la coincidencia sea a lo largo de todo el genoma del virus, por lo que puedes elegir una región que ya has comprobado que no coincide con el genoma de nada más. Así evitas preguntas como, se me habrá contaminado la muestra con algo?? Y te aseguras que con la técnica de la RT-PCR sólo estés amplificando lo que tú quieres, que en este caso es el genoma del COVId. Espero haberte respondido ��
Perfectamente respondido y explicado. Muchas gracias de nuevo por el post y por el blog en general. ¡Ah!…y por los libros que ha publicado.
Fernando
Si das PCR+ varias veces y en tu serologia tienes IGMneg e IGG+ estarías curado e inmune pero seguirias siendo contagioso?
¿Cuando podria darse sino ese caso?
Excelente Explicación.
Muy buena explicación. Gracias
Nosotros tenemos que estar consientes si nos tenemos que hacer un test y con esta informacion me da un amplio conocimiento de la prueba. Ademas me agrada que nos explique el contenido del virus, excelente informacion.
Que significa, igm +(positivo), igg – (negativo) y PCR negativo
No hubo mejor manera para explicarlo, excelente explicación. Con lo que estamos viviendo actualmente, hay que mantenernos informados sobre el COVID 19 y sobre sus pruebas diagnosticas.
En el caso de los test antigenicos, hay falsos positivos, por reaccion cruzada con otros antigenos de otros coronavirus u otros virus por ejemplo?
Magnífica explicación. Los ejemplos ayudan mucho a entender la complejidad real y el carácter estadístico de todas estas pruebas. Gracias por tu valiosísima labor divulgativa
Sí que me surge una pregunta. ¿Si en lugar de combinar Test RT-PCR con test de anticuerpos serológicos se combinara con los test antigénicos se obtendría una mayor sensibilidad y especificidad promedio? Los test de antígenos parecen ir más orientados a detectar portadores del virus, sean éstos asintomáticos, tempranos o de infección prolongada (como ocurre al final con la PCR). Los test de anticuerpos, sin embargo, parecen más orientados a detectar a pacientes recuperados o con reacciones agudas o exposiciones más prolongadas al virus. ¿Está demostrado que alguna combinación pueda ser más efectiva que la otra, o se tienen al menos algunos datos preliminares? Gracias de antemano y enhorabuena por tu trabajo y por el merecido reconocimiento que estás recibiendo 😀
Enhorabuena por otro nuevo artículo instructivo y muy interesante, Fernando. De nuevo de muestras que todo el reconocimiento que estás recibiendo es sin duda merecido.
La explicación de los conceptos más teóricos es muy amena y comprensible, y se agradece mucho que incluyas ejemplos prácticos para comprender la dificultad de dar resultados puramente estadísticos en este tipo de pruebas.
Si me permites, me ha surgido una duda tras la lectura. ¿Es posible que la combinación RT-PCR y test antigénico resulte más efectiva en cuanto a especificidad y sensibilidad que realizando la prueba serológica de anticuerpos? Por lo que parece el test de antígenos va más orientado a detectar pacientes infectados (salvo los falsos positivos de sujetos recuperados con restos del virus todavía presentes), al igual que la PCR; mientras que los test de anticuerpos parecen ir más dirigidos a detectar individuos recuperados o infectados en un estado particularmente agudo o prolongado de la infección. ¿Existe evidencia al respecto? Muchas gracias de antemano por la respuesta, y de nuevo reitero mi enhorabuena y mi agradecimiento como aficionado a la medicina y a la biología en general 😀
Me ha encantado….Esta explicado muy claro y fácil de entender
A Ver si alguien si alguien me puede ayudar a entender mis resultados.
11/03: PCR+
07/04: PCR-, IGM 0 y IGG 0,12 Au/ml
He creado anticuerpos? teóricamente es negativo en anticuerpos, pero se me hace muy raro que tras un PCR + no haya generado anticuerpos. Puede que sea un caso de infección intracelular?
Todas las infecciones por virus son intracelulares. Es perfectamente posible haber pasado la enfermedad y no haber generado anticuerpos.
En el test de Ac con detección de IgA e IgG en una persona joven (20-25 años), es posible que no se detecten Ac y que la persona haya pasado la infección?
Una explixación muy buena!
Soy una médica de Hungría, también escribí sobre este tema en húngaro, pero no puedo dibujar cómo tú, podría usar dos de tus dibujos con mencionar la fuente por supuesto? Si quieres pudiera enviarte mi redacción sobre este tema.
Puede usar todo el material disponible en este blog. Un saludo.
Saquenmen bien una duda ya me hice el examen Igg sale positivo pero en el IgM sale negativo estoy confundido xfaaa ayudenme
Gracias por su maravillosa exposición.
Entoces para hacer un buen control epidemiologico deberíamos hacer conjuntas y como complementarias los test de PCR y los test de Ig del paciente, porque podemos tener una única prueba del genoma positivo pero no sabemos q en etapa está el paciente inmunológicamente o tener una IgG positiva sin saber si todavía existe carga viral y por tanto pueda seguir contagiando, o tener una PRR que sea falso negativo y que también podría seguir contagiando.En sanitarios esto sería muy importante el hacer ambos tests complementarios, ¿es correcta mi interpretación?
Un saludo
Este ha sido el mas completo e interesante articulo que he leido . Está muy bueno!!!!!
Muchas gracias Nacho. Muy claro como siempre.
Seguro que el alumnado de 2º de Bachillerato lo entiende perfectamente.
Bien
No entiendo como todavia nuestros doctores de cuadro medico no disponen de dichos test
Antes de que lleguen los test para todo el mundo, debemos de tomar medidas para protegernos. El coronavirus esta ahí y las empresas deben de tener sus carteles informativos.
Efectivamente: Test, Test,Test
Hola. Muy bueno el blog. Solicito permiso para uso de las imágenes de éste post en una web de divulgación acerca del COVID19 en Uruguay. Muchas gracias
De muchísima utilidad para mi labor docente con mis alumnos.
Excelente trabajo!! Una duda. A día de hoy, 25 de mayo, son válidos los test serológicos IgM/IgG? Que se utilizará más para detección en organismos , empresas, grandes plataformas.. los IgM/IgG o los IgA? Parece ser que estos últimos no son más sensibles o más específicos que los anteriores según informan algunos…aunque tu (permiteme tutearte)comentas que si.
Muy buena la explicación.
A mí lo que me trae de cabeza es que mi suegra ha pasado el coronavirus y estaba en casa de mi cuñada conviviendo con cinco personas y éstas han dado negativo en IgM y IgG. Medidas de prevención las justas porque no sabían que tenían coronavirus, solamente se le había agravado la demencia, no pensaron en ningún momento que se tratase de coronavirus, se dieron cuenta al realizar el test serologico que fue +, para ingresarla en una residencia cuando se pudiera.
Yo también me hice el test serologico por si el contagio hubiera sido cuando estaba cerca de nosotros, se fue con su hija después, y también IgG 0.01 y IgM 0.44, negativo. Todos los test eran con la prueba ELISA.
Cómo se explica que un virus tan contagioso y no estén contagiados los que están a su alrededor? Entiendo que no todas las personas desarrollan anticuerpos pero 5 personas sin síntomas y sin anticuerpos y conmigo 6?
La respuesta se llama inmunidad celular.
¿Y la inmunidad celular? Si un paciente es capaz de eliminar el virus con TCD8+, podría haber pasado la enfermedad sin generar anticuerpos.
Contra el coronavirus debes de llevar mascarilla. Las de tela reutilizables son muy buenas.
buenas tardes, quería ver si alguien me puede aclarae un tema.
Como se puede interprerar una PCR positiva, asintomático, y al cabo de 11 dias realizar una analítica y las inmunoglobinas IGM e IGG con resultado negativo??? falso positivo PCR? q se hiciera una analitica en una fase que ya este resuelta la infección por lo tanto IGM negativas , pero y las IGG? no tendrían q salir "positivas?
periodo "ventana " de 12 días?